化学系杜为红课题组依托校级计算服务发表高水平论文
中国人民大学化学系许举飞博士生在杜为红老师的指导下,提出了一个淀粉样多肽与青蒿素衍生物的相互作用的方法-分子动力学模拟 (称为MD 模拟), 用于探索在淀粉样多肽寡聚体被解聚的机理以及结合位点等。此研究成果的计算资源由中国人民大学校级高性能与大数据公共计算云提供。以往的热力学以及构像改变的方法仅仅探索出其可以改变多肽的二级结构而并不能知晓其具体的位点和相互之间的氢键结合情况,且伴随着二级结构变化含量的不确定性。MD模拟不仅探索了多肽与小分子结合的位点,更能通过其二级结构结构的变化得到两者之间的氢键结合以及小分子在多肽表面分布的情况。相关研究成果以“Regulation of Artemisinin and Its Derivatives on the Assembly Behavior and Cytotoxicity of Amyloid Polypeptides hIAPP and Aβ”在线发表在《ACS·化学神经科学》(ACS Chemical Neuroscience)上。
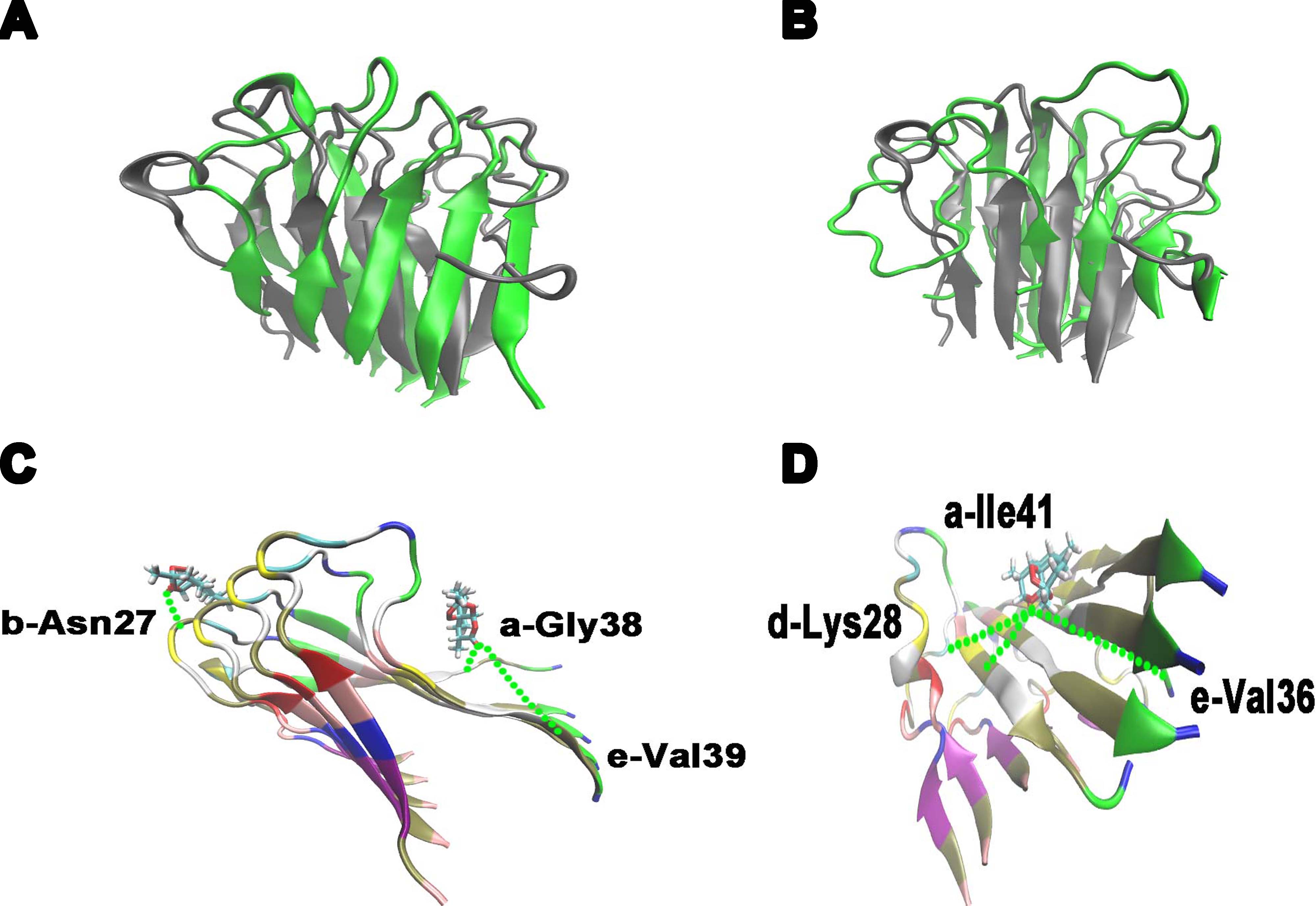
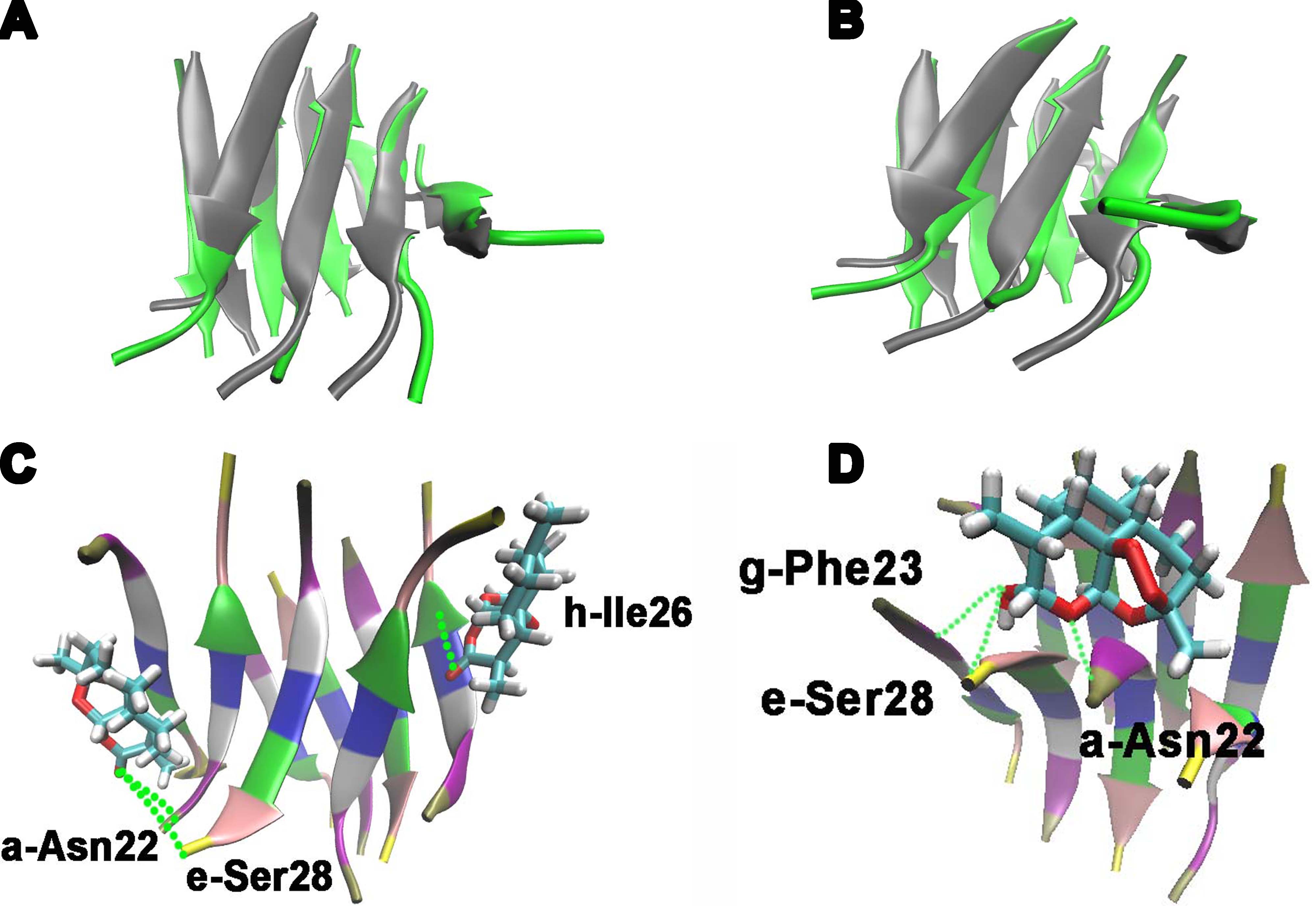 在淀粉样多肽聚集过程中,它们会引起一系列的淀粉样变性的相关疾病,如糖尿病、阿尔兹海默症、帕金森症等疾病。一个重要且关键的抑制剂对于多肽的抑制和解聚对延缓这些疾病的恶化是非常关键的,它是指在两个多肽hIAPP 和 Aβ寡聚体上与青蒿素和双氢青蒿素相结合。相关研究表明hIAPP 和 Aβ聚集体与多种疾病(比如2型糖尿病、阿尔兹海默症等)、人体健康状况等具有联系。MD 模拟分析即是通过青蒿素及其衍生物探测与这两个多肽的氢键结合位点和多肽表面的小分子分布情况。但是,多肽寡聚体是已经聚集好的寡聚体,也就是说对于不同的青蒿素及其衍生物的某个氢键结合位点,它在不同淀粉样多肽聚集体中的氢键结合位点以及结合几率会有所不同,从而可能只在某些特定的小分子结合位点上和多肽上特定的氨基酸残基有结合。MD 模拟的提出对探索出这样具有结合特异性的氢键结合位点和结合几率提供了可能。
在淀粉样多肽聚集过程中,它们会引起一系列的淀粉样变性的相关疾病,如糖尿病、阿尔兹海默症、帕金森症等疾病。一个重要且关键的抑制剂对于多肽的抑制和解聚对延缓这些疾病的恶化是非常关键的,它是指在两个多肽hIAPP 和 Aβ寡聚体上与青蒿素和双氢青蒿素相结合。相关研究表明hIAPP 和 Aβ聚集体与多种疾病(比如2型糖尿病、阿尔兹海默症等)、人体健康状况等具有联系。MD 模拟分析即是通过青蒿素及其衍生物探测与这两个多肽的氢键结合位点和多肽表面的小分子分布情况。但是,多肽寡聚体是已经聚集好的寡聚体,也就是说对于不同的青蒿素及其衍生物的某个氢键结合位点,它在不同淀粉样多肽聚集体中的氢键结合位点以及结合几率会有所不同,从而可能只在某些特定的小分子结合位点上和多肽上特定的氨基酸残基有结合。MD 模拟的提出对探索出这样具有结合特异性的氢键结合位点和结合几率提供了可能。